香川大学医学部 自律機能生理学
教授 平野 勝也
生理学、分子血管生物学、循環器内科学
2019/07/26 掲載
研究結果の概要

欧州心臓学会(European Society of Cardiology)が発行する国際英文誌Cardiovascular Research誌の2019年7月号に発表した研究(文献1)では、血液凝固因子であるトロンビンが作用し、血管の収縮や構造変化を引き起こすことが知られている細胞膜受容体PAR1の機能を阻害すると、肺高血圧症の病態形成が抑制され、生存率が改善することを、肺高血圧症モデル動物を用いた実験から明らかにしました。肺高血圧症の成り立ちには、血管の収縮と構造変化に加えて血栓形成が重要な役割を果たすことが知られています。今回の研究により血液凝固系は、本来の機能である血栓形成のみならず、受容体を介して血管の収縮や構造変化を引き起こすことによって肺高血圧症の病態形成に重要な役割を果たすことが明らかとなりました(図1)。この点でこの研究成果には学術的な新しさがあります。また、PAR1拮抗薬は、現在臨床現場で用いられている肺高血圧症治療薬とは異なる作用機序を有する薬であり、本研究成果は新たな肺高血圧症治療薬の開発につながる点で、臨床医学への貢献が期待されます。しかしながら、私どもの研究は未だ動物実験レベルであり、PAR1拮抗薬が肺高血圧症の患者さんにおいても安全に使用でき、治療効果を発揮するかは、今後の研究により明らかにする必要があります。
研究の背景
肺高血圧症は、右心室から出て、肺でガス交換を行う肺循環系の血圧が上昇する病気です。全身をめぐる体循環系の血圧が上昇する、いわゆる高血圧症とは、その成り立ちも治療法も大きく異なります。肺動脈圧を測定するためには心臓カテーテル検査が必要となり、平均肺動脈圧が25 mmHgを超えると肺高血圧症と診断されます。現在、肺高血圧症は5つの群に分類され、そのうち肺動脈性肺高血圧症と慢性血栓塞栓性肺高血圧症の2つの群が我が国において難病指定されており、2017年現在、それぞれ3,456人および3,439人の患者さんが登録されています(平成29年度特定医療費受給者証所持者数)。
肺高血圧症の特異的薬物治療は20余年前に始まりました。現在、プロスタサイクリン製剤、エンドセリン受容体拮抗薬、ホスホジエステラーゼ5阻害剤の3剤が標準的な治療薬として用いられています。これらの治療薬の導入により、肺高血圧症患者の生命予後は改善し、特に日本において、肺動脈性肺高血圧症は極めて良好な治療成績を上げています(Ogawa et a., Am J Cardiol 119: 1479-1484, 2017)。しかしながら、特に重症例では、生命予後は未だ満足すべき状況になく、国内外で新たな治療薬の開発が進められています。
新しい治療薬を開発するには、病気の成り立ちをよく理解することが前提となります。肺高血圧症は肺血管抵抗が進行性に上昇することを特徴とする疾患であり、肺血管抵抗の上昇には、血管の収縮、血管の構造変化(血管壁の肥厚と内腔の閉塞)、血管内の血栓形成が重要な役割を果たします。この結果、血管内腔が閉塞し、肺血管抵抗が上昇します。肺高血圧症患者の肺動脈のなかには高頻度で血栓が観察され、抗凝固薬が一部の患者さんで生命予後を改善することが報告されています。血液凝固系が肺高血圧症の成り立ちに関わることが示唆されます。しかしながら、血液凝固系がどのようにして肺高血圧症の発症や進展に寄与するかについては不明な点が残っていました。
血液凝固系と血管との相互作用は、肺高血圧症にとどまらず、多くの血管の病気の成り立ちに重要な役割を果たします。1991年米国の研究チームによって、凝固因子であるトロンビンが作用する細胞膜受容体PAR1が発見され、血液凝固系が血管に作用する仕組みを分子レベルで理解できるようになり、研究が大きく進展しました。この受容体には、血管の収縮や構造変化を引き起こす作用があることが明らかにされています。1996年からこの受容体の生理機能や病気との関わりについて研究を重ねており、これまでに英文原著論文30編、英文著書1編、英文総説7編、和文総説10編を報告してきました。その中で、2010年に肺循環系は体循環系に比べてトロンビンに対する反応性が高いことを報告しました(文献2, 3)。
肺循環系がトロンビンに対して高い反応性を示すこと、トロンビンはPAR1を介して血管の収縮と構造変化を引き起こすこと、さらに、肺高血圧症において高頻度で血栓が観察されること、これらを考え合わせると、凝固系は単に血栓形成を引き起こすだけではなく、PAR1を介して血管の収縮や構造変化を引き起こし、肺高血圧症の発症や進展に関わると考えるに至りました。PAR1を阻害することによって肺高血圧症の病態を改善できるという仮説が立てられます(図1)。この度報告した研究は、肺高血圧症のモデル動物を用いてこの仮説を検証したものです。
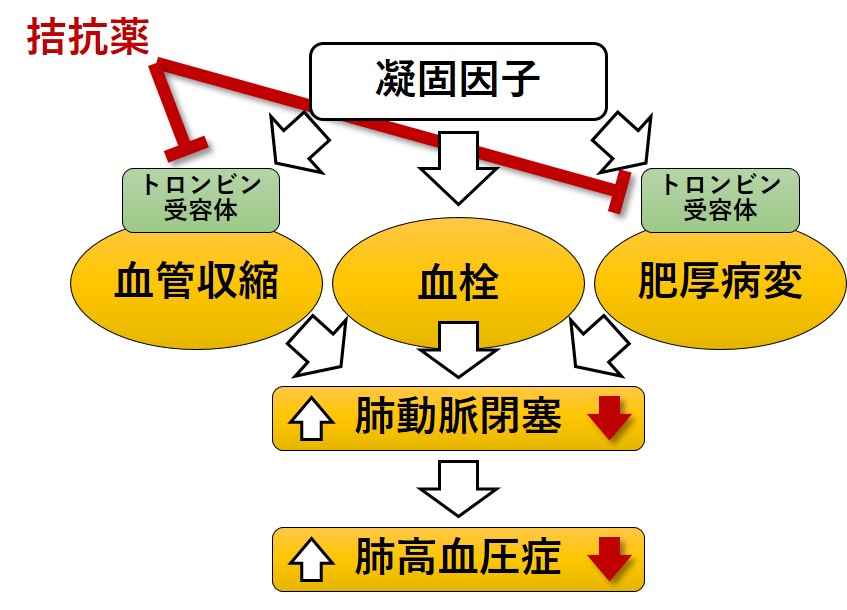
図1 肺高血圧症における凝固系の役割(仮説)
研究の成果
PAR1を阻害するために2つの方法を用いました。一つは薬物によって阻害する方法です。PAR1は血小板の活性化を引き起こすことが知られており、PAR1拮抗作用を有する低分子量化合物が新たな抗血小板薬として開発されています。製薬企業から開発中の化合物の提供を受け、研究に用いました。もう一つの方法としてPAR1を欠損するマウスを用いました。
研究ではラットおよびマウスの肺高血圧症モデル動物を作製しました。ラットでは、植物由来天然化合物モノクロタリンを1回皮下注射することによって肺高血圧症を誘導しました。マウスでは、10%酸素の低酸素環境下で飼育し、肺高血圧症を誘導しました。いずれも肺高血圧症のモデルとして汎用されているものです。これらの動物実験は、本学動物実験委員会の承認を得て実施しています。
モノクロタリン誘発肺高血圧症ラットにおいて、肺動脈におけるPAR1の発現が亢進し、摘出肺標本を用いた灌流実験からPAR1刺激によって引き起こされる肺動脈圧上昇反応も亢進することを認めました。すなわち、正常と比べて肺高血圧症の病態においては肺動脈のPAR1の発現と機能が亢進していることが明らかとなりました。モノクロタリン注射の当日、あるいは、投与2週間後の肺高血圧症の病態が完成した後からPAR1拮抗薬を毎日経口投与すると(治療群)、肺高血圧群に認められる肺血管抵抗の上昇、右室肥大、肺動脈の構造変化(中膜肥厚病変形成)が抑制され、生存率が有意に改善しました(図2)。
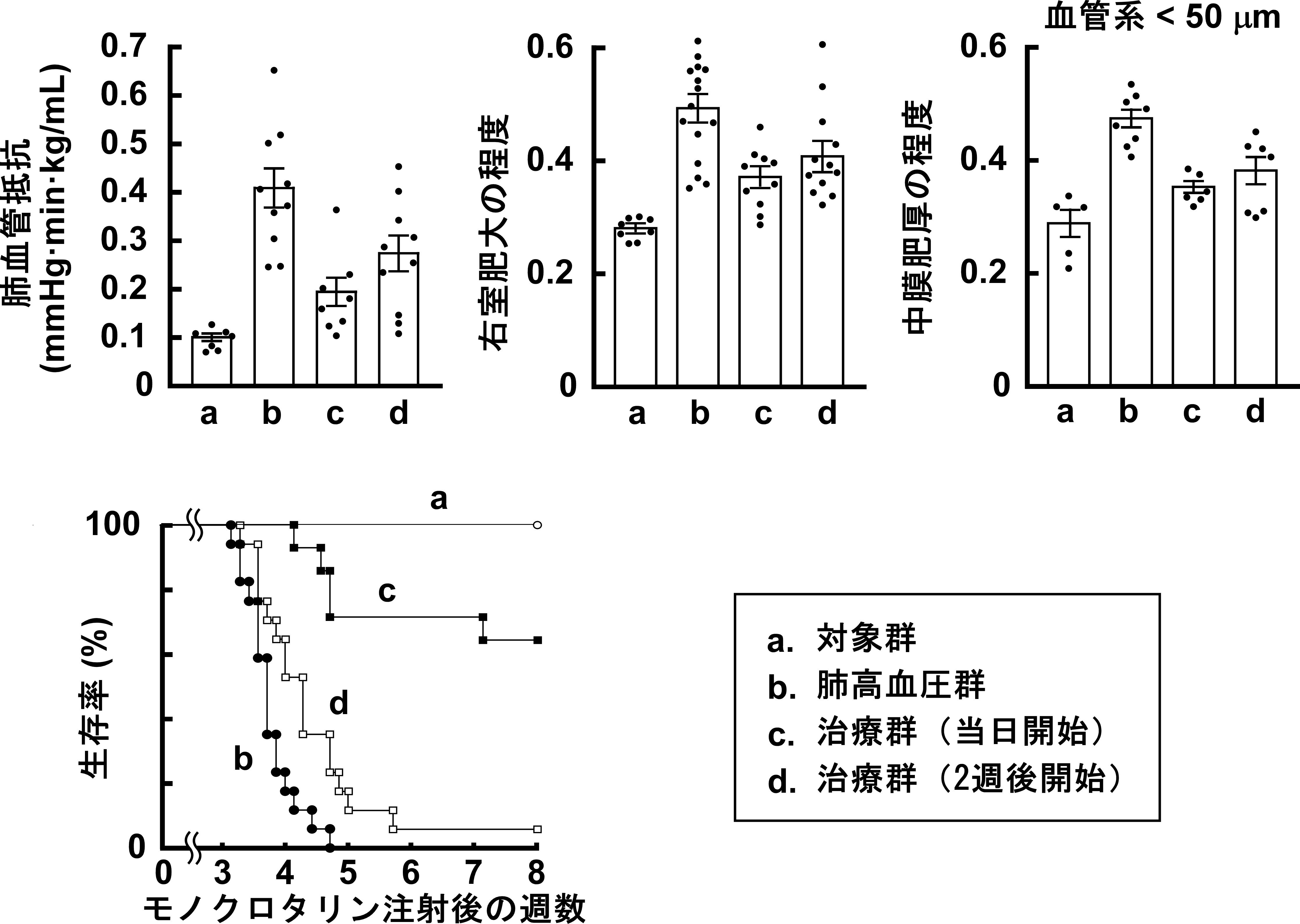
図2 モノクロタリン誘発肺高血圧ラットにおいて観察されたPAR1
拮抗薬による病態抑制効果と生存率の改善(文献1より改訂引用)
正常酸素濃度で飼育した場合、野生型マウスとPAR1欠損マウスで、右室収縮期圧(肺動脈収縮期圧の指標)、右室肥大の程度、細動脈の筋性化の程度に差はありません。しかし、低酸素飼育によって引き起こされる右室収縮期血圧の上昇、右室肥大の形成、細動脈の筋性化の亢進が、PAR1欠損マウスにおいて抑制されました(図3)。
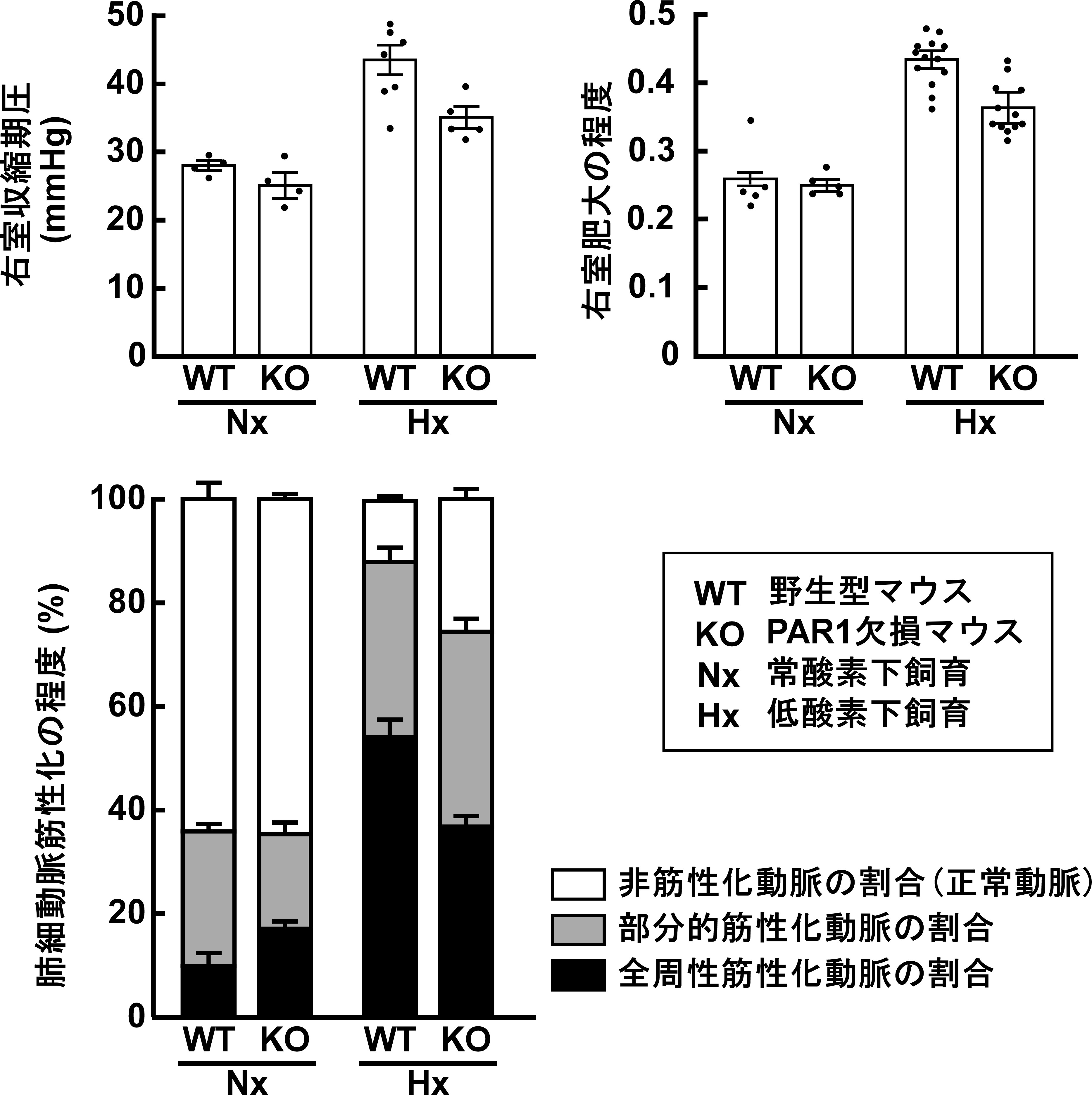
図3 低酸素誘発肺高血圧症マウスにおいて認められたPAR1遺伝子欠損
による病態抑制効果(文献1より改訂引用)
2種類のPAR1を阻害する方法と2種類の肺高血圧モデル動物を用いて、PAR1の阻害により肺高血圧症の病態が改善することが示されました。
研究の魅力
研究には様々な魅力があります。世界中の誰も知らない神秘を自分だけが知っていると実感する瞬間に大きな知的興奮が得られるのが研究の第一の魅力です。深い森を抜け、誰よりも先に頂に立って風景を眺めている様な、爽快な喜びが感じられます。また、研究成果が教科書の知見を書き換えたり、何らかの形で社会の役に立った時に感じる喜びも魅力の一つです。さらに、研究の興味を同じくする世界中の研究者とともに学術的知見を積み上げる作業に従事していることを実感し、世界を意識して日々活動できることも研究の魅力の一つです。
今回論文発表した研究の魅力の一つは、肺高血圧症における血液凝固系の役割に関する考え方にパラダイムシフトを与えたことです。従来、血液凝固系は、血栓形成を介して血管閉塞を引き起こし、肺高血圧症の発症に関わるとされていました。私どもの研究により、凝固系は受容体を介して血管の収縮や構造変化を引き起こし、肺高血圧症の発症に関わることが明らかとなりました。もう一つの魅力は、現在行われている肺高血圧症の治療薬とは作用機序が異なる新しい治療法を提案できた点です。この治療法は、体循環系と比べて肺循環系はトロンビンに対する高い反応性を示すとする独自の知見に基づいており、肺循環系に特異的に作用する点において従来の治療薬に優れることも、本研究成果の魅力の一つです。さらに、今回の研究成果の重要性が他の研究者によって認知され、論文掲載誌の巻頭で新たな肺高血圧症治療薬の開発につながる画期的な研究として紹介されたことも、研究成果に魅力があることを示しています(Merkus et al., Protease-activated receptor 1 as potential therapeutic target in pulmonary arterial hypertension. Cardiovasc Res 115(8): 1260-1261, 2019)。肺高血圧症の研究領域において、私どもが研究してきたトロンビン受容体PAR1が新たな治療標的として認識されるに至りました。
研究を始めたきっかけ
血液凝固系と血管壁の相互作用は、動脈硬化を含め様々な血管病の発症や進展に重要な役割を果たすことが知られていました。1991年にカリフォルニア大学サンフランシスコ校の研究者によってトロンビン受容体PAR1がクローニングされたことを受け、凝固系と血管壁との相互作用を分子レベルで明らかにし、新たな血管病治療の開発に資する研究を計画しました。6年間の米国での研究生活を終えて帰国した1996年秋に遡ります。
PAR1による血管緊張調節機構の研究から開始しました。多くの動物種の多くの血管において内皮依存性の血管弛緩作用を観察することができました。血管の種類によっては内皮依存性の血管収縮作用も観察されました。しかしながら、体循環系の様々な血管を用いて研究を行いましたが、平滑筋に対する直接の収縮作用を観察することはありませんでした(文献4)。一方、クモ膜下出血モデルやバルーン血管傷害モデルの病変部血管においては、平滑筋細胞でPAR1の発現が亢進し、正常では反応しなかったトロンビンに対して平滑筋が過剰な収縮反応を示すようになることを見出しました(文献5-7)。
2004年、肺循環系におけるPAR1の血管緊張調節作用を調査したところ、内皮依存性の血管弛緩反応に加えて、平滑筋収縮作用が観察されました。正常の血管においてPAR1による平滑筋収縮作用が観察されたのはこれまでの研究で初めてのことでした。肺循環系の血管は体循環系の血管とは異なる特性を持つことが知られています。良く知られている現象は低酸素に対する反応の違いです。体循環系の血管は低酸素に対して弛緩反応を示すのに対して、肺循環系の血管は収縮反応を示します。PAR1による平滑筋収縮作用もこのような肺循環系の特性の一つであると考えられました。この特性の発見が今回の研究の基盤となっています。なお、PAR1による肺動脈平滑筋収縮作用については、活性酸素が関与し、カルシウムに依存しない、特殊な平滑筋収縮機構が関与することを明らかにし、2010年に2報の論文を発表しました(文献2, 3)。
肺高血圧症の病態形成には、血管の収縮、構築変化、血栓形成が関与することが知られており、2004年にPAR1を介した肺血管の高い収縮反応性を観察してすぐにこの特性が肺高血圧症の病態形成に重要な役割を果たすという仮説が立てられました(文献8)。一方、クモ膜下出血モデルにおける平滑筋PAR1の発現亢進と血管攣縮反応性がPAR1拮抗薬で抑制されることを2007年に報告していました(文献5)。PAR1拮抗薬と遺伝子ノックアウトの病態抑制効果を肺高血圧モデルを用いて検証すれば、肺高血圧症におけるPAR1の役割を証明でき、新たな肺高血圧症の治療標的を確立できると考えられ、この度の研究の着想に至りました。
この研究の将来的な展望
本研究の次のステップは、例えば医師主導型臨床試験を実施し、実用化への道筋を作ることです。PAR1拮抗薬は新たな抗血小板薬として開発が進められた経緯があります。米国の製薬企業が開発した化合物は米国内で認可を受け、臨床応用がなされています。また、国内企業が開発した化合物も第2相臨床試験を完了しており、いずれの化合物も人に応用する際の一定の安全性が既に担保されています。肺高血圧症の患者さんを対象に、現行の治療薬に上乗せしてPAR1拮抗薬を投与し、その有効性を証明することができれば、肺高血圧症の治療に新たな戦略を提供でき、肺高血圧症患者のさらなる予後の改善に貢献することが展望されます。
趣味
ハイキングと写真。月に1度の割合で近隣の山を一人歩きしています。道中、風景や四季の変化を写真に収めています。撮影した写真は講義の幕間スライドに利用しています。
引用文献
1.Kuwabara Y, Tanaka M, Abe K, Hirano M, Hirooka Y, Tsutsui H, Sunagawa K, Hirano K. Proteinase-activated receptor 1 antagonism ameliorates experimental pulmonary hypertension. Cardiovasc Res 115(8): 1357-1368, 2019.
2.Maki J, Hirano M, Hoka S, Kanaide H, Hirano K. Thrombin activation of proteinase-activated receptor 1 potentiates the myofilament Ca2+-sensitivity and induces vasoconstriction in porcine pulmonary arteries. Br J Pharmacol 159(4): 919-927, 2010.
3.Maki J, Hirano M, Hoka S, Kanaide H, Hirano K. Involvement of reactive oxygen species in thrombin-induced pulmonary vasoconstriction. Am J Respir Crit Care Med 182(11): 1435-1444, 2010.
4.Hirano K. The roles of proteinase-activated receptors in the vascular physiology and pathophysiology. Arterioscler Thromb Vasc Biol 27(1): 27-36, 2007.
5.Maeda Y, Hirano K, Kai Y, Hirano M, Suzuki SO, Sasaki T, Kanaide H. Up-regulation of proteinase-activated receptor 1 and increased contractile responses to thrombin after subarachnoid hemorrhage. Br J Pharmacol 152(7): 1131-1139, 2007.
6.Kai Y, Hirano K, Maeda Y, Nishimura J, Sasaki T, Kanaide H. Prevention of the hypercontractile response to thrombin by proteinase activated receptor-1 antagonist in subarachnoid hemorrhage. Stroke 38(12): 3259-3265, 2007.
7.Fukunaga R, Hirano K, Hirano M, Niiro N, Nishimura J, Maehara Y, Kanaide H. Upregulation of proteinase-activated receptors and hypercontractile responses precede development of arterial lesions after balloon injury. Am J Physiol Heart Circ Physiol 291(5): H2388 H2395, 2006.
8.Hirano K. The unique property of the pulmonary artery regarding the smooth muscle effects of proteinase-activated receptor 1: The possible contribution to the pathogenesis of pulmonary hypertension, in Diagnosis treatment of pulmonary hypertension - From bench to bedside, ed Fukumoto Y, Springer Singapore, Singapore, 77-87, 2017.
発表論文のURL
https://academic.oup.com/cardiovascres/article/115/8/1357/5181164
Kuwabara Y, Tanaka M, Abe K, Hirano M, Hirooka Y, Tsutsui H, Sunagawa K, Hirano K. Proteinase-activated receptor 1 antagonism ameliorates experimental pulmonary hypertension. Cardiovasc Res 115(8): 1357-1368, 2019
研究室URL
謝辞
本研究は以下の研究資金の支援を受けて実施したものです。この場を借りて謝意を表します。
平成28~30年度日本学術振興会科学研究費補助金基盤研究C:トロンビン受容体を標的とする新規肺高血圧治療法の開発(研究代表者)
平成27~29年度日本学術振興会科学研究費補助金基盤研究C:プロテイナーゼ活性化型受容体1を介する血管機能障害の分子機構解明(研究分担者)
平成29年度タケダリサーチサポート:プロテイナーゼ活性型受容体PAR1を標的とする新たな肺高血圧治療の開発(研究代表者)
平成27年度香川大学医学部重点化経費に係るプロジェクト:トロンビン受容体を標的とした新たな肺高血圧治療法開発のための生理学および病態生理学研究(研究代表者)
平成27年度百十四銀行学術文化振興財団 産業・学術部門助成:トロンビン受容体を標的とする肺高血圧症治療の新戦略・香川プロトコルの研究開発(研究代表者)