香川大学医学部 生体分子医学講座 生化学
教授 上田 夏生
2019/1/7 掲載
受賞の概要

このたび2018年度日本ビタミン学会 学会賞を受賞し、2018年11月4日に大阪医科大学で開催された日本ビタミン学会創立70周年記念シンポジウムで執り行われた授賞式および受賞講演で表彰を受けました。本賞は公益社団法人日本ビタミン学会により、我が国におけるビタミン学の進歩発展に功績のあった本会正会員である研究者に授与される賞です。受賞研究題目は、「必須脂肪酸由来の生理活性脂質と関連脂質分子に関する酵素学的研究」です。本学会は昭和24年(1949年)5月に設立され、「ビタミンの進歩、発展に貢献し、もって国民の健康増進に寄与する」をモットーにして活発な活動を展開しています。ここでは受賞研究の主な成果である脂肪酸エタノールアミドの代謝酵素の研究について紹介します。

2018年度日本ビタミン学会 学会賞授賞式および受賞講演にて
研究の背景
脂肪酸とその関連物質からなる「脂質」は、脂肪(トリアシルグリセロール)、リン脂質、コレステロールなどを含んでおり、肉や油を大量に摂取する現在の食生活では肥満や動脈硬化の原因として悪者扱いされることも多いですが、本来は体内に長期蓄えることのできるエネルギー源として、あるいは細胞を形作る生体膜の主要成分として、生物にとって不可欠な物質です。脂質の重要な働きの3つ目は、細胞間の情報伝達です。プロスタグランジンやステロイドホルモンなどがよく知られていますが、さまざまな「生理活性脂質」が細胞膜や細胞内に存在するレセプタータンパク質に、鍵と鍵穴のように特異的に結合することで細胞外から細胞内へ情報を伝えます。
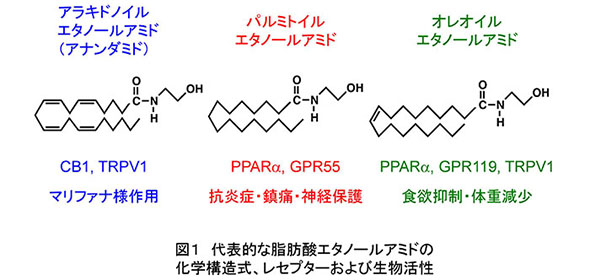
脂肪酸とエタノールアミンが縮合してできている「脂肪酸エタノールアミド」(N-アシルエタノールアミンとも呼ばれます)は、微量ですが動植物を含む自然界に広く分布し、近年、ヒトやマウスなど哺乳動物で作用する生理活性脂質の1グループとして注目されています(図1)(文献1、2)。そのうち、脂肪酸がアラキドン酸である分子「アナンダミド」は、大麻(マリファナ)の精神作用と密接に係わりのあるカンナビノイド・レセプターの作動物質として脳から見つかり、アナンダミドを投与された動物はマリファナ様の異常を呈します。また、パルミチン酸のエタノールアミドは、ペルオキシソーム増殖剤活性化レセプター(PPAR)α等と結合して抗炎症・鎮痛・神経保護作用を、オレイン酸のエタノールアミドは同じくPPARα等を介して食欲を抑制することが知られています(図1)。
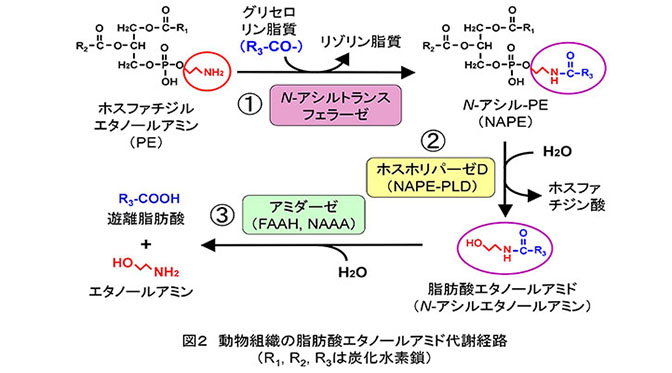
これら脂肪酸エタノールアミドは、ヒトやマウスの体内でも合成されることがわかっています。その経路はリン脂質のひとつであるホスファチジルエタノールアミン(PE)を原料にして、2段階の反応で作られます(図2の①と②)。分解経路は、遊離脂肪酸とエタノールアミンへの加水分解です(図2の③)。これらの合成・分解反応は、すべて酵素の触媒により進行します。私は1992年に報告されたアナンダミドの発見(文献3)に触発され、アナンダミドを含む脂肪酸エタノールアミドの生合成・分解に係わる酵素に興味を持ちました。当時、代謝経路の概略は既に明らかになっていましたが(文献4)、経路を構成する酵素タンパク質の構造や機能はよくわかっていませんでした。結果的に、私はこの方面の研究を今日に至るまで25年以上続けることになりました。
研究の成果
私たちが世界に先駆けて発見またはcDNAクローニングに成功した脂肪酸エタノールアミドの代謝に係わる3種類の酵素に関する研究成果を紹介します。
1.N-アシルエタノールアミン水解酸性アミダーゼ(NAAA)
はじめに脂肪酸エタノールアミドを遊離脂肪酸とエタノールアミンに加水分解する酵素に注目しました(図2の③)。研究の過程で、既によく知られていた「脂肪酸アミド加水分解酵素(FAAH)」とは異なる新規酵素を発見しました。FAAHの触媒する反応が中性からアルカリ性のpHで効率よく進むのに対し、ある白血病細胞ではアナンダミドの加水分解反応の至適pHが酸性であることに気付いたことが発見のきっかけでした。この酵素をラットの肺から均一にまで精製してcDNAクローニングを行い、全アミノ酸配列を決定しました(文献5)。そしてこの酵素を「N-アシルエタノールアミン水解酸性アミダーゼ(NAAA)」と命名しました。NAAAはアミノ酸の配列上、酸性セラミダーゼと類似性を示すリソソーム酵素であること、脂肪酸エタノールアミドの中でもパルミトイルエタノールアミドと高い反応性を示すこと、マクロファージや前立腺で特に強く発現していることなどを明らかにしました(文献6)。この酵素の特異的阻害剤は新たな抗炎症・鎮痛剤として期待され、現在、世界各地で開発が進められています(文献7)。
2.N-アシル-PE水解ホスホリパーゼD(NAPE-PLD)
研究対象を生合成経路にも広げ、脂肪酸エタノールアミドの前駆体であるN-アシル-ホスファチジルエタノールアミン(NAPE)から脂肪酸エタノールアミドを遊離するホスホリパーゼD(PLD)型の酵素(NAPE-PLD)の研究に着手しました(図2の②)。NAPEは1分子あたり脂肪酸鎖を3本持つ稀なリン脂質分子です。苦心の末、NAPE-PLDをラット心臓から精製し、cDNAクローニングに世界で初めて成功しました(文献8)。本酵素は、アミノ酸配列が既知のPLDと類似していない亜鉛含有タンパク質でした。ホスファチジルコリンなどの、よく知られたリン脂質とはほとんど反応せず、NAPEだけを加水分解する高い基質特異性を持った酵素であることもわかりました。本酵素の遺伝子欠損マウスを解析すると、脳などの組織でNAPEの蓄積が見られましたが、脂肪酸エタノールアミドの量はゼロにはならず、脂肪酸エタノールアミドを生成するための代替経路が体内に存在することが明らかになりました(文献9)。
3.Ca2+非依存性N-アシルトランスフェラーゼ
脂肪酸エタノールアミドの生合成経路の第一段階は、PEのアミノ基に、別のリン脂質分子から脂肪酸鎖を転移してNAPEを生成する反応で、反応を担う酵素はN-アシルトランスフェラーゼと呼びます(図2の①)。私たちは、この反応がレシチン・レチノール・アシルトランスフェラーゼ(LRAT)という酵素の触媒する反応と似ていることに注目し、LRATとN-アシルトランスフェラーゼアのアミノ酸配列が類似しているという仮説を立てました(文献10)。がん抑制遺伝子群として報告されていたHRASLSファミリーの5種類のタンパク質がLRAT類似タンパク質であることがわかり、私たちは活性の強弱に違いはあるものの、5種類すべてがN-アシルトランスフェラーゼとして作用しうることを発見しました(文献11)。この反応を触媒する酵素を同定できたのは動植物、微生物を問わず初めてのことでした。私たちはさまざまな名前で呼ばれていた5種類のタンパク質をそれぞれ「ホスホリパーゼA/アシルトランスフェラーゼ(PLAAT)-1〜5」と改称することを提案しました。PLAAT-1〜5は酵素活性の発現にCa2+イオンを必要とせず、その後、米国のグループが同定したCa2+要求性N-アシルトランスフェラーゼ(文献12)と区別するため、PLAAT-1〜5をまとめてCa2+非依存性N-アシルトランスフェラーゼと呼びます。
この研究の将来的な展望
私たちはこれら一連の研究成果により、ヒトやマウスにおける脂肪酸エタノールアミドの代謝経路の解明に貢献することができたと思います。脂肪酸エタノールアミドはさまざまな生物活性を示す生理活性脂質であることから、これらの酵素の阻害剤は医薬品としての開発が期待されています。今後は、これらの酵素の遺伝子欠損マウスを用いるなどして、脂肪酸エタノールアミドや関連分子の生理的意義の解明に向け、より一層努力したいと思います。
謝辞
紹介した一連の硏究成果は、私が徳島大学医学部在籍時に開始し,2001年に香川医科大学 生化学講座(現・香川大学医学部 生体分子医学講座 生化学)に異動した後、発展させたものです。この間、本講座所属の教職員、学生はもとより、国内外の多数の共同研究者から多大なご指導、ご協力を賜りました。この場を借りて心より感謝申し上げます。
引用文献
1. Ueda N, Tsuboi K, Uyama T (2013) Metabolism of endocannabinoids and related N-acylethanolamines: Canonical and alternative pathways. FEBS J 280, 1874-1894
2. Hussain Z, Uyama T, Tsuboi K, Ueda N (2017) Mammalian enzymes responsible for the biosynthesis of N-acylethanolamines. Biochim Biophys Acta 1862, 1546-1561
3. Devane WA, Hanuš L, Breuer A, Pertwee RG, Stevenson LA, Griffin G, Gibson D, Mandelbaum A, Etinger A, Mechoulam R (1992) Isolation and structure of a brain constituent that binds to the cannabinoid receptor. Science 258, 1946-1949
4. Schmid HHO, Schmid PC, Natarajan V (1990) N-Acylated glycerophospholipids and their derivatives. Prog Lipid Res 29, 1-43
5. Tsuboi K, Sun Y-X, Okamoto Y, Araki N, Tonai T, Ueda N (2005) Molecular characterization of N-acylethanolamine-hydrolyzing acid amidase, a novel member of the choloylglycine hydrolase family with structural and functional similarity to acid ceramidase. J Biol Chem 280, 11082-11092
6. Ueda N, Tsuboi K, Uyama T (2010) N-Acylethanolamine metabolism with special reference to N-acylethanolamine-hydrolyzing acid amidase (NAAA). Prog Lipid Res 49, 299-315
7. Bottemanne P, Muccioli GG, Alhouayek M (2018) N-Acylethanolamine hydrolyzing acid amidase inhibition: tools and potential therapeutic opportunities. Drug Discov Today 23, 1520-1529
8. Okamoto Y, Morishita J, Tsuboi K, Tonai T, Ueda N (2004) Molecular characterization of a phospholipase D generating anandamide and its congeners. J Biol Chem 279, 5298-5305
9. Tsuboi K, Okamoto Y, Ikematsu N, Inoue M, Shimizu Y, Uyama T, Wang J, Deutsch DG, Burns MP, Ulloa NM, Tokumura A, Ueda N (2011) Enzymatic formation of N-acylethanolamines from N-acylethanolamine plasmalogen through N-acylphosphatidylethanolamine-hydrolyzing phospholipase D-dependent and -independent pathways. Biochim Biophys Acta 1811, 565-577
10. Jin X-H, Okamoto Y, Morishita J, Tsuboi K, Tonai T, Ueda N (2007) Discovery and characterization of a Ca2+-independent phosphatidylethanolamine N-acyltransferase generating the anandamide precursor and its congeners. J Biol Chem 282, 3614-3623
11. Uyama T, Ikematsu N, Inoue M, Shinohara N, Jin X-H, Tsuboi K, Tonai T, Tokumura A, Ueda N (2012) Generation of N-acylphosphatidylethanolamine by members of the phospholipase A/acyltransferase (PLA/AT) family. J Biol Chem 287, 31905-31919
12. Ogura Y, Parsons WH, Kamat, Cravatt BF (2016) A calcium-dependent acyltransferase that produces N-acyl phosphatidylethanolamines. Nat Chem Biol 12, 669-671